高一化学能与热能(高一化学能与热能知识点)
知识网络
重难突破
一、化学反应中能量变化的原因
1、化学反应的本质是原子(或原子团)的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成。
2、物质中的原子之间是通过化学键结合的。断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。
3、在25 ℃和101 kPa的条件下,由原子形成1 mol化学键时所放出的能量,与断开1 mol相同化学键所吸收的能量是相等的。
4、利用化学键的能量变化计算化学反应中的能量变化

例1、下列关于化学反应的说法中不正确的是()
A.化学反应过程中一定有热量释放出来
B.化学反应的特征是有新物质生成
C.化学反应的过程实际上是一个旧键断裂、新键形成的过程
D.在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等
【答案】A
例2、已知1 g氢气完全燃烧生成水蒸气时放出能量121 kJ,且氧气中1 mol O==O键完全断裂时需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为()
A.920 kJB.557 kJC.436 kJD.188 kJ
【答案】C
二、化学反应过程中能量变化图示
1.各种物质都储存有化学能,不同的物质所储存的化学能不同。化学反应中,物质发生了变化,化学能也随之而改变,化学反应过程中吸收或放出能量可用下图形象地表示:
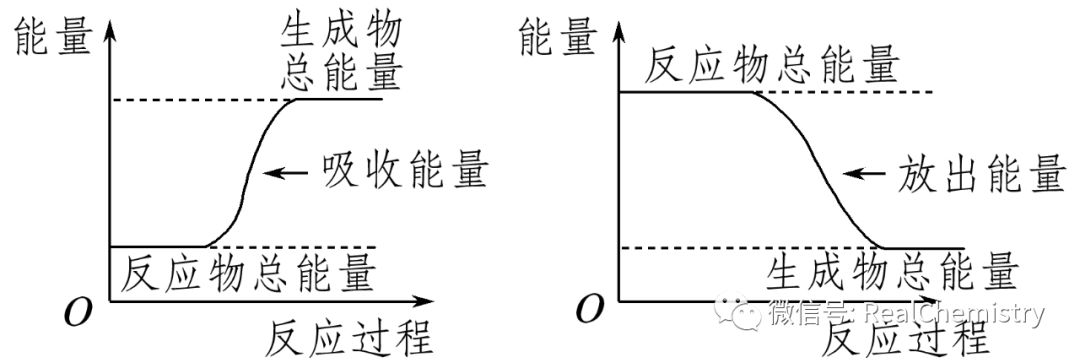
2.物质具有的能量越低,断开其中的化学键需要的能量越多,该物质越稳定;物质具有的能量越高,断开其中的化学键需要的能量越少,该物质越不稳定。
例3、下列说法正确的是()
A.任何化学反应都伴随着能量的变化
B.H2O(g)===H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
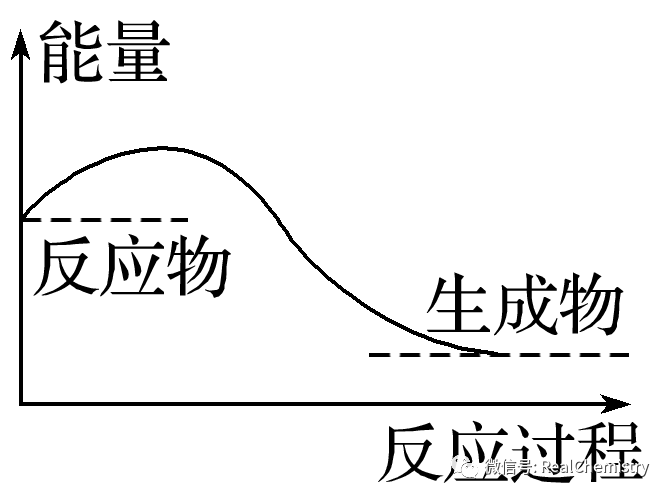
【答案】A
例4、下列图示变化为吸热反应的是()
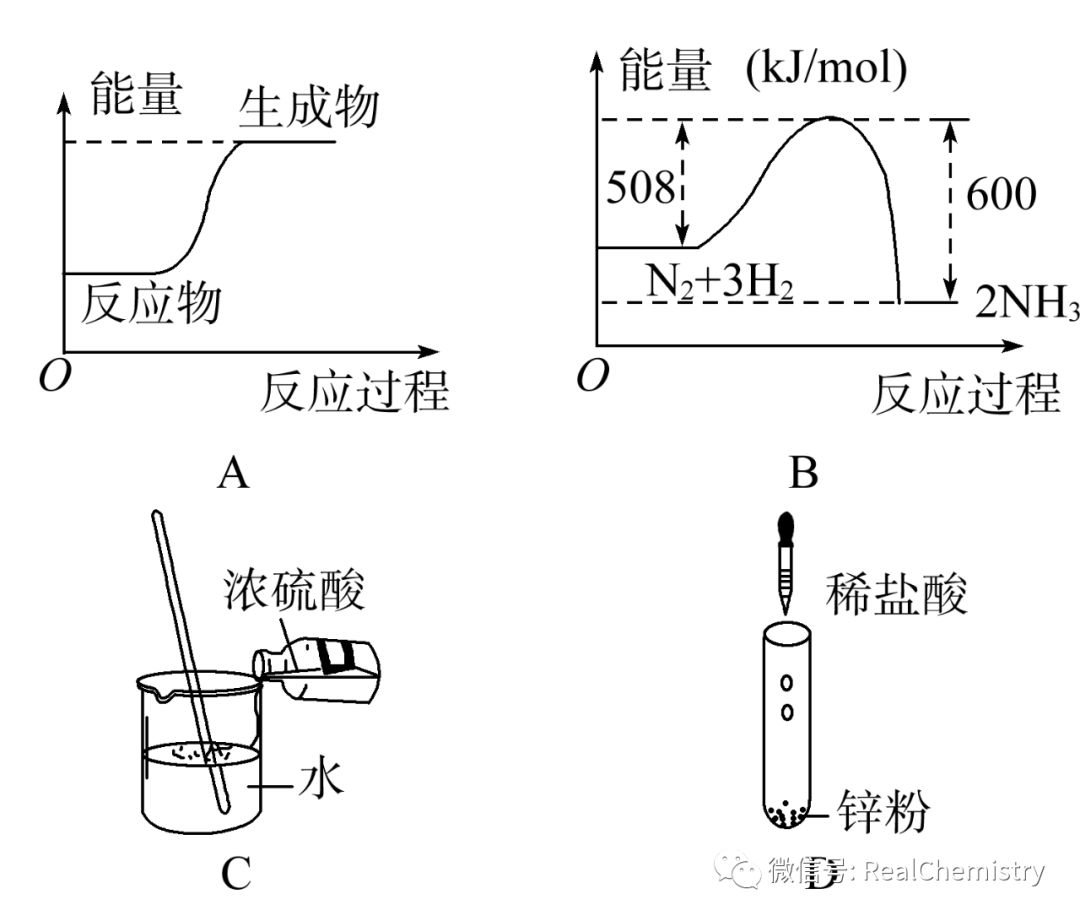
【答案】A
三、放热反应和吸热反应
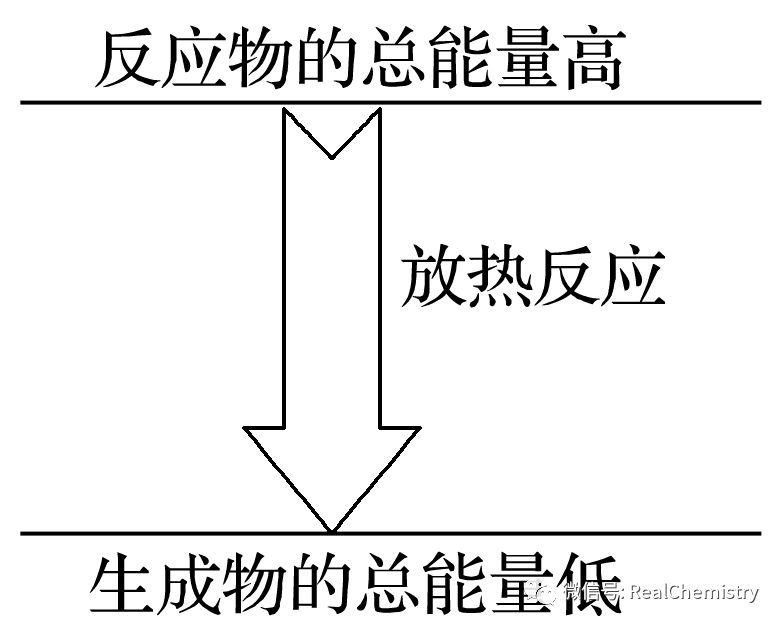
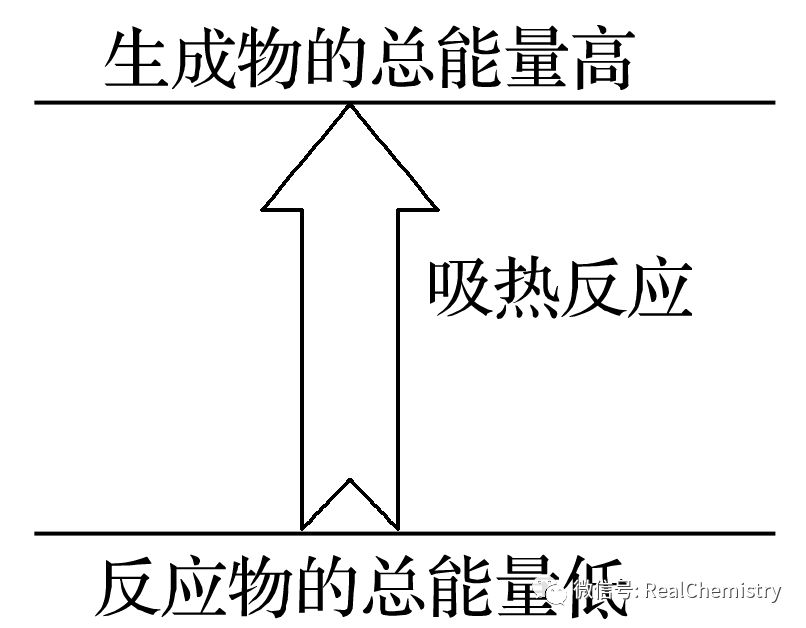
1、化学反应中的能量变化有多种形式,但通常主要表现为热量的变化。因此化学反应分为两类:放热反应和吸热反应。请填写下表:
类型 比较 | 放热反应 | 吸热反应 |
定义 | 放出热量的化学反应 | 吸收热量的化学反应 |
成因 | 反应物具有的总能量大于生成物具有的总能量
| 反应物具有的总能量小于生成物具有的总能量
|
图示 | ||
与化学键强弱的关系 | 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 | 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量 |
2、常见的放热、吸热反应:
①常见的放热反应有
a燃烧反应
b酸碱中和反应
c活泼金属与水或酸的反应
d大多数化合反应
②常见的吸热反应有:
a氢氧化钡晶体和氯化铵晶体混合发生反应
b CO2+C = 2CO
c大多数的分解反应
例5、下列说法正确的是()
①需要加热才能发生的反应一定是吸热反应②放热反应在常温下一定很容易发生③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④B.只有①②C.①②③④D.②③④
【答案】A
例6、将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是()
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
【答案】B
四、化学能与热能相互转化的应用
1.化学能与热能的相互转化在生活、生产中的应用
化学物质中的化学能通过化学反应转化成热能,提供了人类生存和发展所需要的能量和动力,如化石燃料的燃烧、炸药开山、发射火箭等;而热能转化为化学能是人们进行化工生产、研制新物质不可或缺的条件和途径,如高温冶炼金属、分解化合物等。
2.生物体中的能量转化及利用
能源物质在人体中氧化分解生成CO2和H2O,产生的能量一部分以热量的形式散失;另一部分作为可转移能量在人体内利用(如合成代谢)。
3.人类利用能源的三个阶段:柴草时期、化石能源时期和多能源结构时期。可再生能源和清洁能源是两类重要的新能源,主要有太阳能、氢能、核能、生物质能等。
例7、有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为()
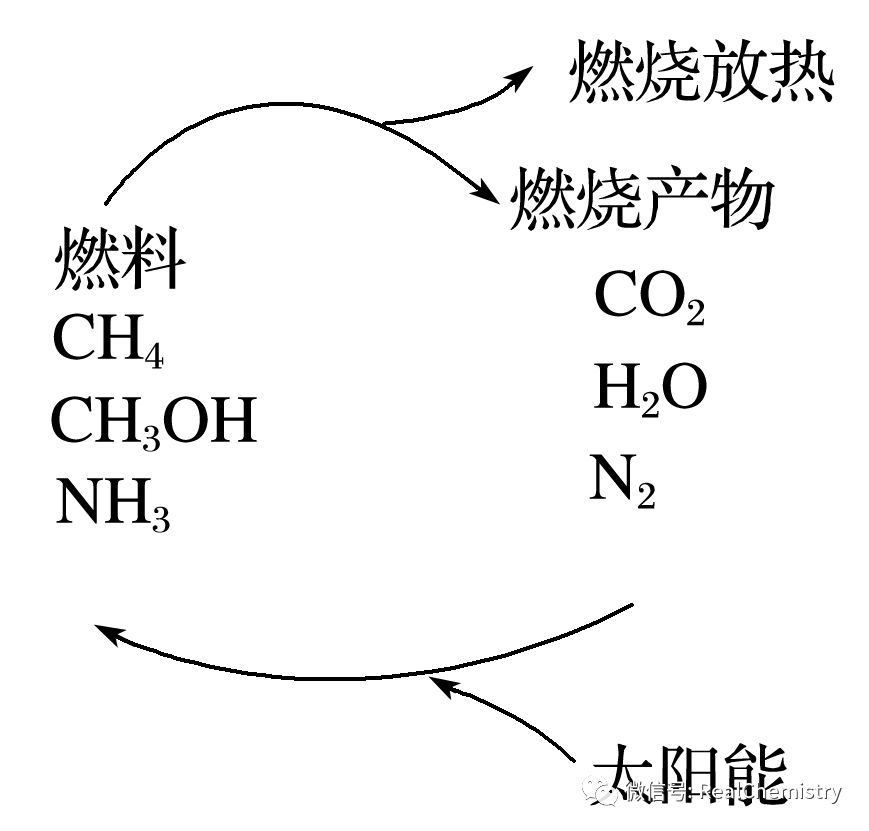
A.化学能B.热能C.生物质能D.电能
【答案】B
例8、能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是热反应,这是由于反应物的总能量(填“大于”“小于”或“等于”,下同)生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量形成生成物中的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧放出的热量为46 000 kJ。试据此分析氢气作为能源代替汽油的优势:。
【答案】(1)放 大于 小于(2)清洁能源,燃烧后无污染环境的物质生成;单位质量放出的热量多
本文由小编发布,不代表一本线高考网立场,转载联系作者并注明出处:https://www.yibenxian.com/gaoyi/56569.html