【高一化学】高考高频考点:原电池(题型+考点+专项训练)
原电池与化学电源知识、规律、题型与方法
一、原电池基础知识
(一)原电池工作原理
(二)原电池正、负极的5种判断方法
(三)几种重要的化学电池
(四)原电池的全面突破
(五)常见化学电源及工作原理
(六)解答新型化学电源的步骤
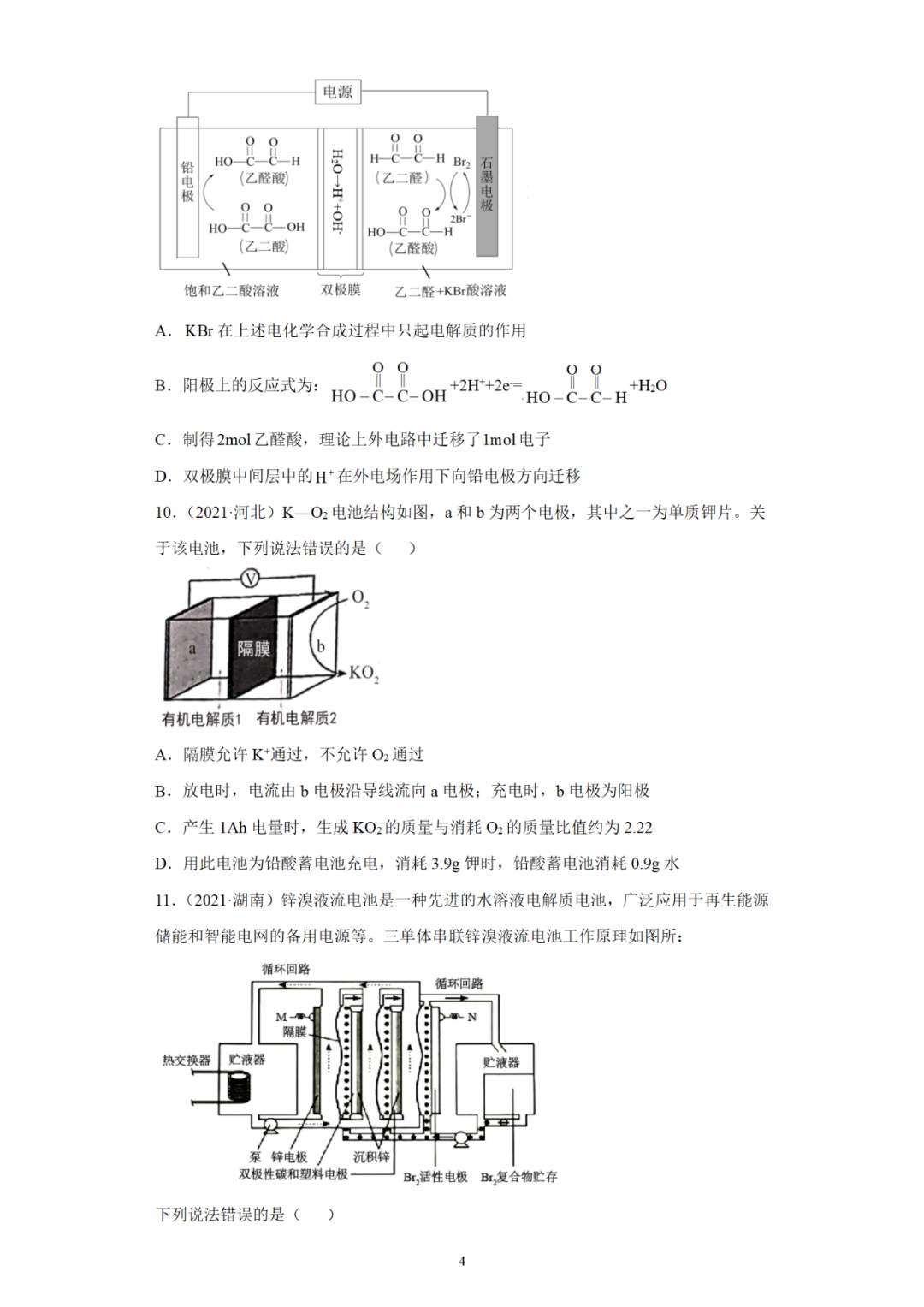
二、原电池原理的应用
(一)判断反应能否发生
(二)加快反应速率
(三)比较金属的活动性强弱
(四)用于金属的防护
(五)设计制作化学电源
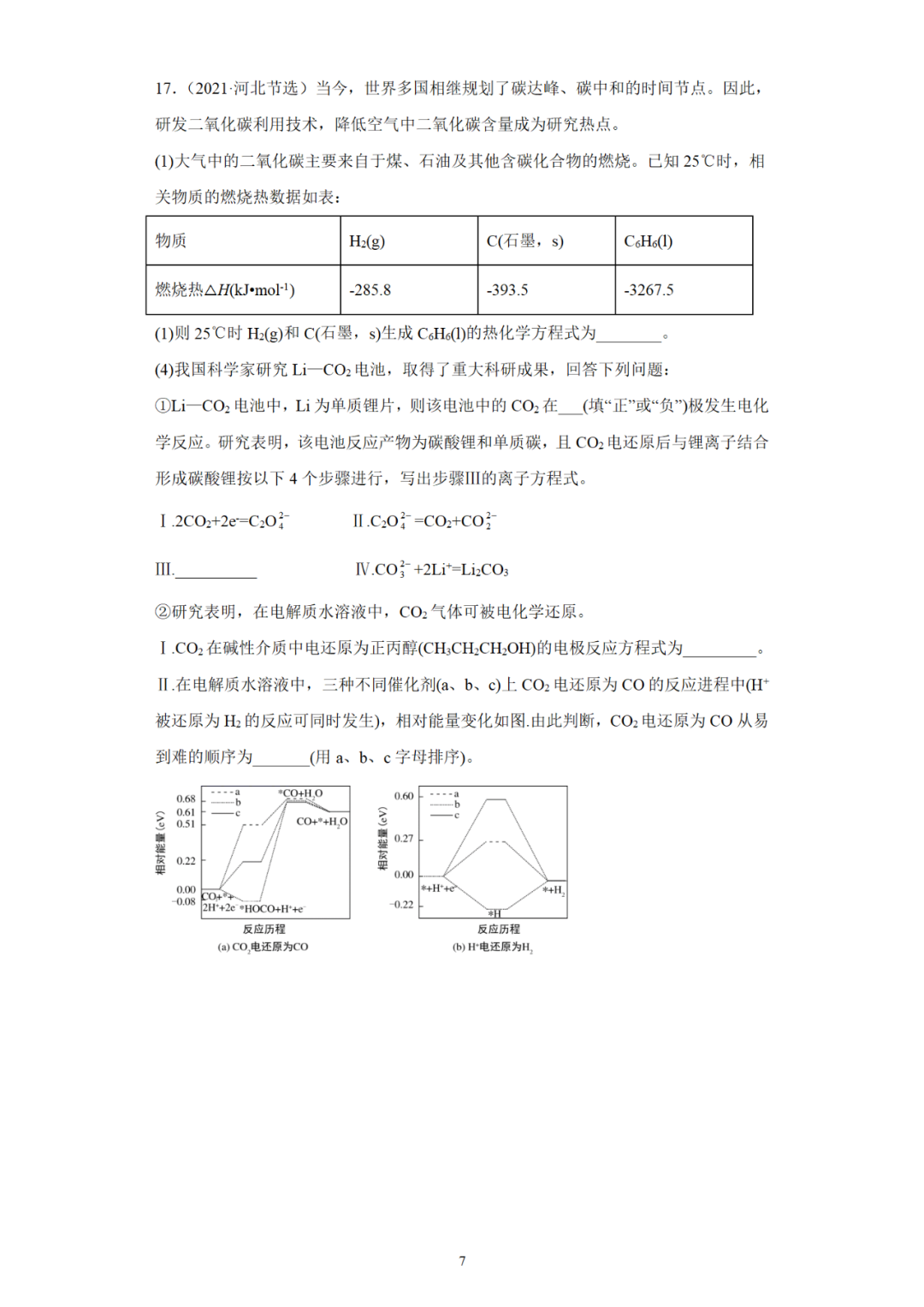
(六)原电池原理与环境保护
(七)原电池原理用于定量测定
三、原电池与化学电源电极反应式书写
(一)电化学中的介质对电极反应的影响
(二)常考的原电池电极反应的书写
(三)“三步”突破原电池电极反应式的书写
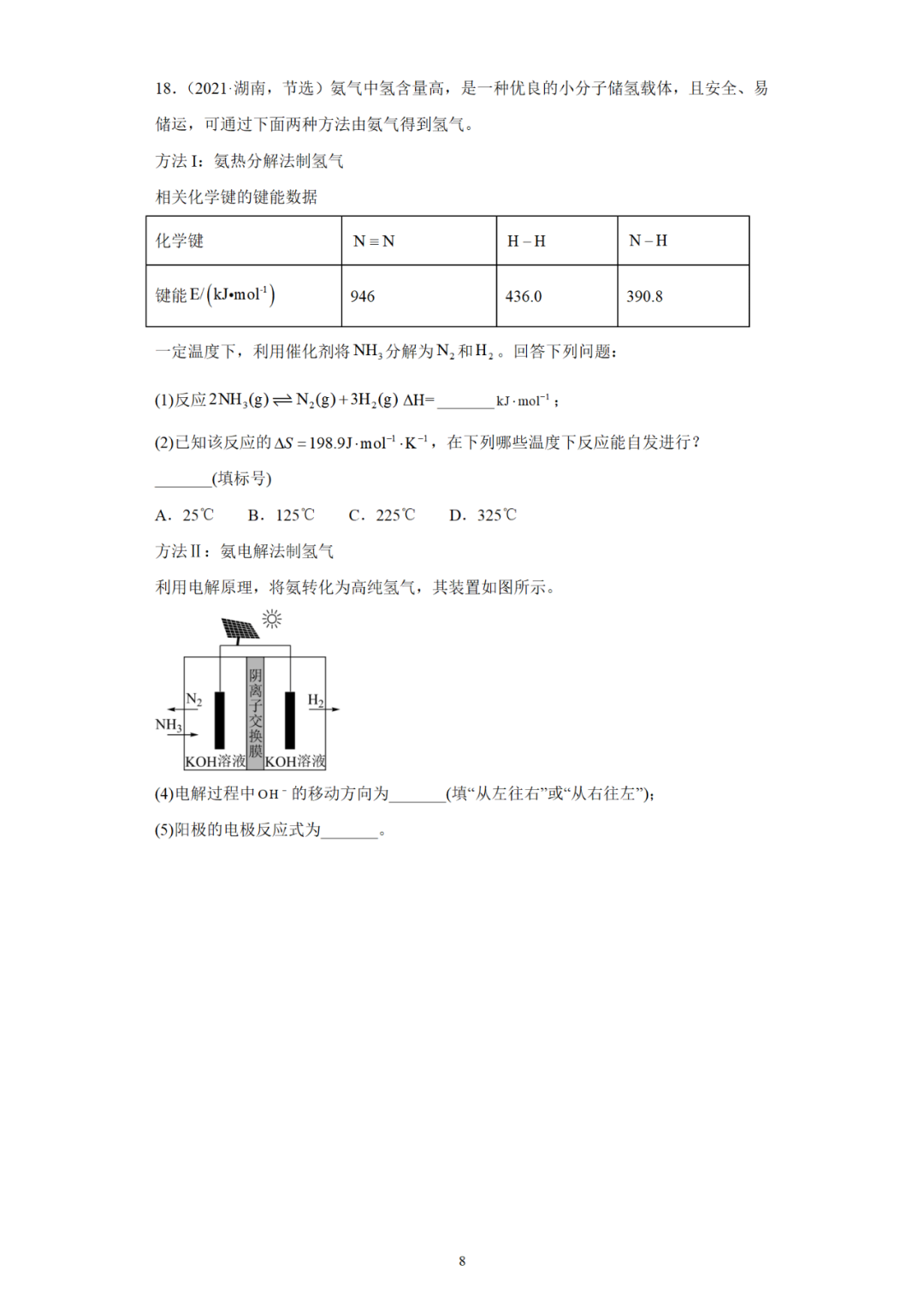
(四)陌生的化学电源电极反应式的书写
(五)新型电池电极反应式汇总
四、各种各样的电池
(一)金属电池
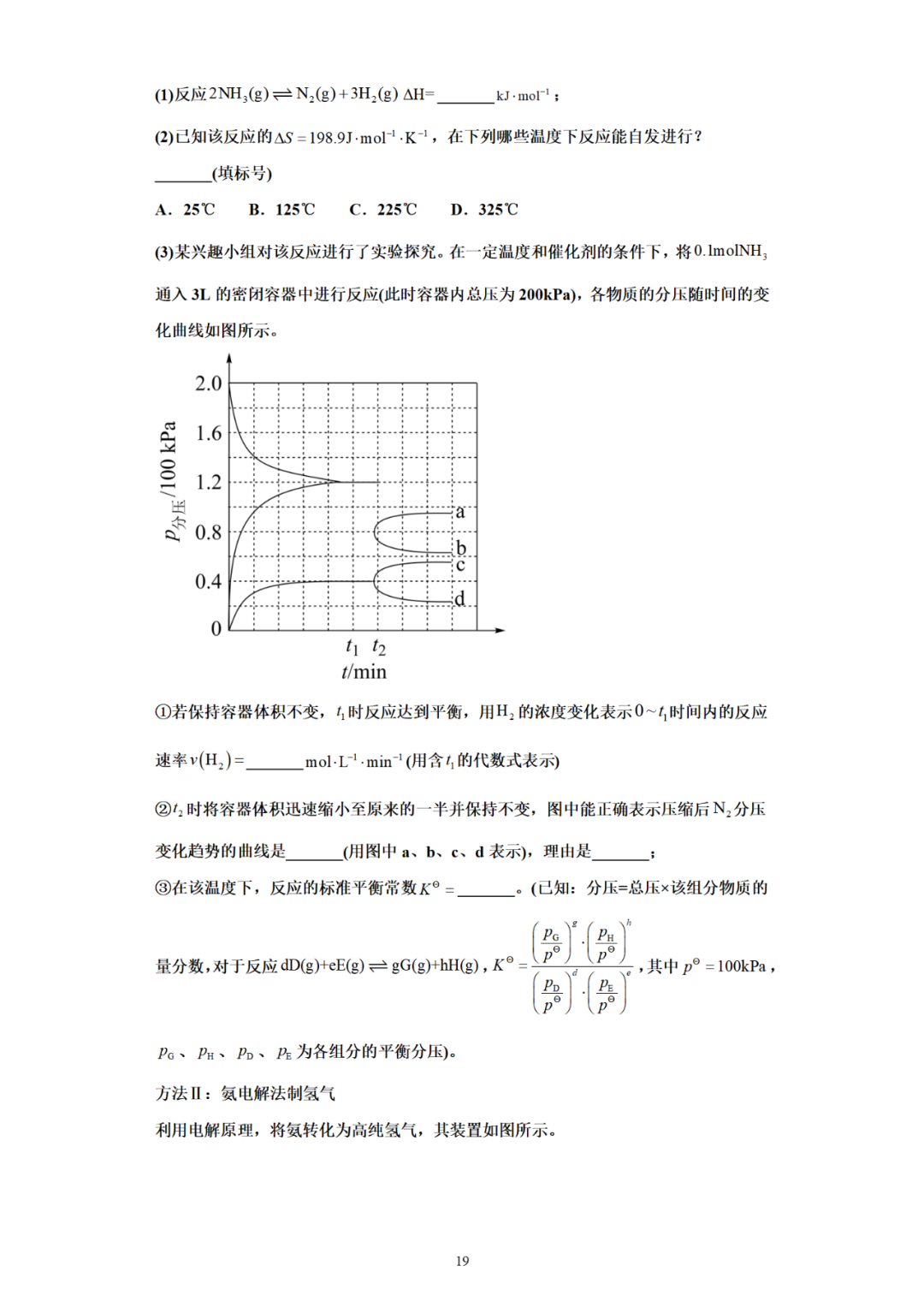
(二)锂电池
(三)锂离子电池
(四)非金属电池
(五)燃料电池
(六)盐与盐电池
(七)浓差电池
(八)微生物电池
(九)全氢电池
(十)熔盐电池
(十一)太阳能电池
(十二)全钒电池
五、离子交换膜与化学电源
六、原电池中离子变化量的计算
七、原电池反应中pH的变化分析
八、原电池与化学电源知识、规律与方法
九、原电池与化学电源题组
重点知识
详细的知识清单,可查看往期推文:
往期推荐(点击下列文字即可跳转原文)
一、原电池电极种类判断
学习原电池知识时,电极种类的判断是个难点,判断的方法、依据有多种,但从如下角度进行分析,则可找到具有普遍意义上的判断技巧。

1.静态判断法
只根据电极材料性质和电解质溶液性质进行判断。
(1)两电极材料均能与电解质溶液直接反应:由于原电池的负极将是提供电子的电极,而较活泼的金属更容易失去电子,因此较活泼的金属作负极。
(2)只有一种电极材料能与电解质溶液直接反应:能反应的材料作负极,如将铝、铜用导线连接起来放入浓HNO3中,因铝在常温下被浓硝酸钝化而铜能与浓硝酸反应,故铜是负极。
(3) 两电极材料均不能与电解质溶液直接反应:在中学化学中,主要为吸氧腐蚀型 (有时也会涉及析氢腐蚀) 的原电池,比较活泼的金属作负极,此类原电池的正极电极反应式为O2 +2H2O+4e-===4OH-(或2H++2e-===H2↑),如钢铁的吸氧腐蚀,铁作负极,碳作正极。

2.依据总反应方程式判断
发生氧化反应的电极是负极(若还原剂是导体材料,则还原剂可直接作负极),如燃料电池中,燃料物质总是在负极上失去电子。

3.动态判断
根据反应过程中电极变化情况进行判断。
(1)依据电子流动方向:有电子流出的电极是负极。
(2)依据离子定向移动方向:由于还原剂在负极上失去电子后形成了阳离子,故负极区带正电,在电场作用下阴离子总是移向负极。
(3)依据反应现象判断:若反应过程中有气体生成,则它一定是正极上形成的。
二、原电池电极反应式的书写

1.书写原则
(1)一致性原则:原电池的负极(正极)发生的反应一定是还原剂(氧化剂)失去(得到)电子的反应。
(2)守恒原则:电极反应式一定要遵循质量守恒和电荷守恒。
(3)共存原则:电极反应式中出现的物质应该能与电解质溶液共存。如Al—Mg—NaOH原电池,铝在负极上失去电子后应生成Al3+,但Al3+在NaOH溶液中会转化为AlO2- ,故负极反应式:Al+4OH--3e—==AlO2—+2H2O。
另外,几种元素或物质在不同酸碱性介质中发生反应后的具体存在形态如表所示,务必记住。
常见元素或物质 | H | C | O2 | Al |
碱性条件 | H2O | CO32- | OH- | AlO2-(强) |
酸性条件 | H+ | CO2 | H2O | Al3+ |

2.书写过程
以2012年课标全国卷第26题中电极反应式的书写为例进行分析:与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________。
(1)先写出氧化剂与还原产物(还原剂与氧化产物)化学式(属于可溶性强电解质的要写成离子形式),并结合元素化合价的变化,标出氧化剂(还原剂)得到(失去)电子的数目。
K2FeO4中的Fe6+在正极上得到电子被还原为Fe3+,铁元素价态变化为3个单位,故有FeO42-+3e-→Fe(OH)3[在碱性条件下,Fe3+转化为Fe(OH)3]。
(2)依据电荷守恒和电解质溶液的酸碱性来添加H+或OH-(牢记:酸性溶液中不能添加OH-,碱性溶液中能添加H+)。本题中介质为碱性溶液,根据电荷守恒,故应在电极反应式右侧添加5OH-得:FeO42-+3e-→Fe(OH)3+5OH-。
(3)依质量守恒原理及左右两侧元素构成添加相应的物质(在溶液中多数情况下是添加水),可得其正极电极反应式为FeO42-+3e-+4H2O==Fe(OH)3+5OH-。再比如:CH3OH-O2燃料电池(硫酸作电解质),因是酸性电解质,碳元素转化为CO2、氢元素转化为H+,O2得电子后转化为H2O,故负极上的电极反应式为CH3OH一6e-→CO2+H+,再根据电荷守恒及质量守恒得CH3OH-6e-+H2O==CO2+6H+,则正极的电极反应式为O2+4e-+4H+==2H2O
此外,原电池中,两个电极反应式的总和就是电池工作时的总反应式。
专题训练(原电池+电解池)


























本文由小编发布,不代表一本线高考网立场,转载联系作者并注明出处:https://www.yibenxian.com/gaoyi/56990.html

