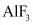2024年上海市普通高中学业水平等级性考试化学试卷
2024年上海市普通高中学业水平等级性考试化学试卷
(考试时间60分钟,满分100分)
一、氟及其化合物
氟元素及其化合物具有广泛用途。
1.下列关于氟元素的性质说法正确的是
A.原子半径最小B.原子第一电离能最大
C.元素的电负性最强D.最高正化合价为+7
2.下列关于 与
与 说法正确的是
说法正确的是
A.是同种核素B.是同素异形体
C. 比
比 多一个电子D.
多一个电子D. 比
比 多一个中子
多一个中子
3.萤石(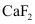 )与浓硫酸共热可制备HF气体,写出该反应的化学方程式:_______,该反应中体现浓硫酸的性质是_______。
)与浓硫酸共热可制备HF气体,写出该反应的化学方程式:_______,该反应中体现浓硫酸的性质是_______。
A.强氧化性B.难挥发性C.吸水性D.脱水性
4.液态氟化氢(HF)的电离方式为: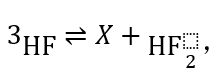 其中X为_______。
其中X为_______。 的结构为
的结构为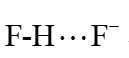 ,其中
,其中 与HF依靠_______相连接。
与HF依靠_______相连接。
5.回答下列问题:
(1)氟单质常温下能腐蚀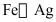 等金属,但工业上却可用
等金属,但工业上却可用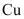 制容器储存,其原因是_______。
制容器储存,其原因是_______。
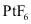 是极强的氧化剂,用
是极强的氧化剂,用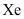 和
和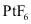 可制备稀有气体离子化合物,六氟合铂氙
可制备稀有气体离子化合物,六氟合铂氙 的制备方式如图所示
的制备方式如图所示
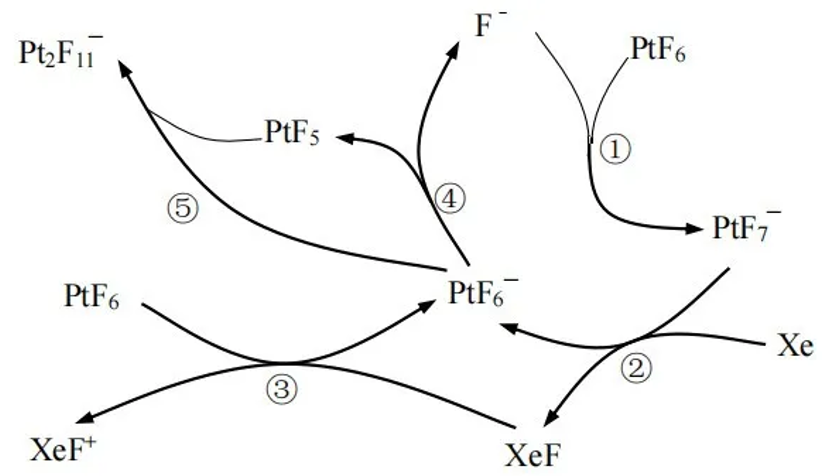
(2)上述反应中的催化剂为_______。
A.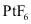 B.
B.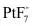 C.
C. D.
D.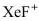
(3)上述过程中属于氧化还原反应的是_______。
A.②B.③C.④D.⑤
(4)氟气通入氙(Xe)会产生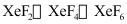 三种氟化物气体。现将
三种氟化物气体。现将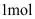 的
的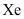 和
和 的
的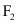 同时通入
同时通入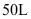 的容器中,反应
的容器中,反应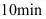 后,测得容器内共有
后,测得容器内共有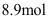 气体,且三种氟化物的比例为
气体,且三种氟化物的比例为 ,则
,则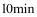 内
内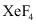 的速率
的速率 _______。
_______。
二、粗盐水的精制
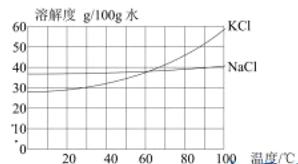
6.粗盐中含有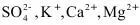 等杂质离子,实验室按下面的流程进行精制:
等杂质离子,实验室按下面的流程进行精制:

已知: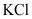 和
和 的溶解度如图所示:
的溶解度如图所示:
(1)步骤①中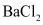 要稍过量。请描述检验
要稍过量。请描述检验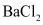 是否过量的方法:_______。
是否过量的方法:_______。
(2)若加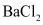 后不先过滤就加氢氧化钠和碳酸钠,会导致_______。
后不先过滤就加氢氧化钠和碳酸钠,会导致_______。
A
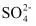 不能完全去除B.消耗更多
不能完全去除B.消耗更多
C.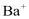 不能完全去除D.消耗更多
不能完全去除D.消耗更多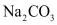
(3)过滤操作中需要的玻璃仪器。除烧杯和玻璃棒外,还需要_______。
A.分液漏斗B.漏斗C.容量瓶D.蒸发皿
(4)步骤④中用盐酸调节pH至3~4,除去的离子有_______。
(5)“一系列操作”是指_______。
A.蒸发至晶膜形成后,趁热过滤B.蒸发至晶膜形成后,冷却结晶
C.蒸发至大量晶体析出后,趁热过滤D.蒸发至大量晶体析出后,冷却结晶
(6)请用离子方程式表示加入盐酸后发生的反应_______。
另有两种方案选行粗盐提纯。
方案2:向粗盐水中加入石灰乳[主要成分为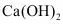 ]除去
]除去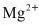 ,再通入含
,再通入含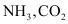 的工业废气除去
的工业废气除去 ;
;
方案3:向粗盐水中加入石灰乳除去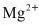 ,再加入碳酸钠溶液除去
,再加入碳酸钠溶液除去 。
。
(7)相比于方案3,方案2的优点是_______。
(8)已知粗盐水中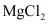 含量为
含量为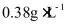 含量为
含量为 ,现用方案3提纯10L该粗盐水,求需要加入石灰乳(视为
,现用方案3提纯10L该粗盐水,求需要加入石灰乳(视为 )和碳酸钠的物质的量_______。
)和碳酸钠的物质的量_______。
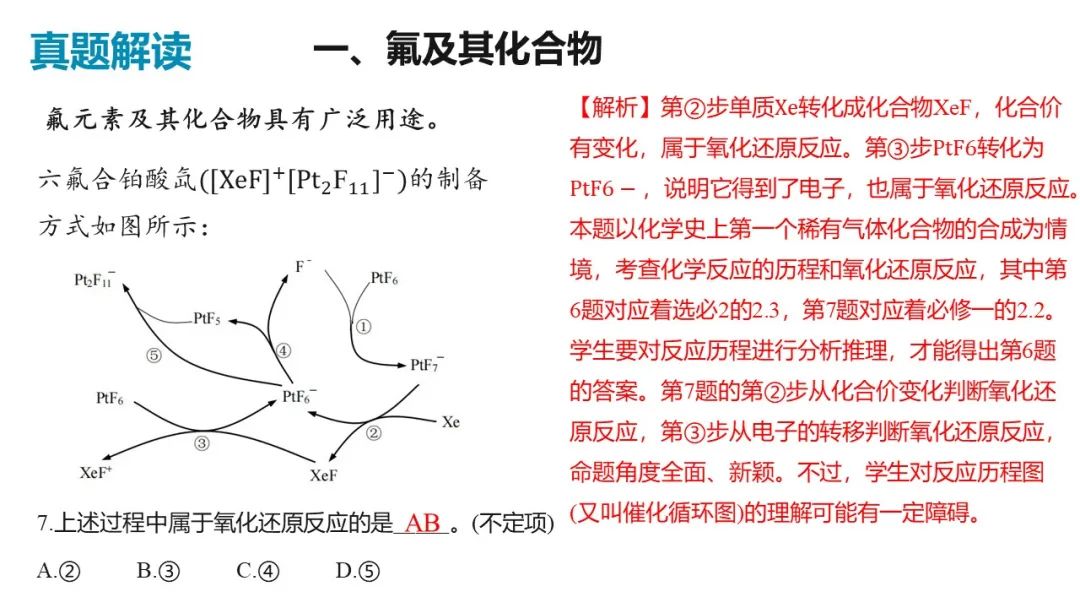
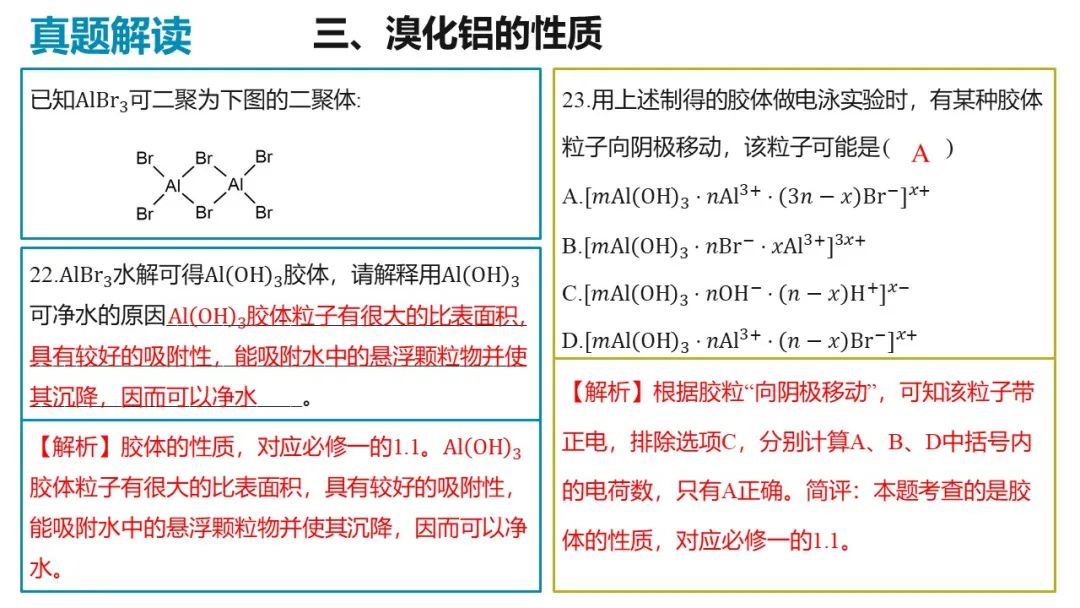
三、溴化铝的性质
7.已知 可二聚为下图的二聚体:
可二聚为下图的二聚体:

(1)该二聚体中存在 化学键类型为_______。
化学键类型为_______。
A.极性键B.非极性键C.离子键D.金属键
(2)将该二聚体溶于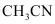 生成
生成 (结构如图所示),已知其配离子为四面体形,中心原子杂化方式为_______,其中配体是_______,该配合物中有
(结构如图所示),已知其配离子为四面体形,中心原子杂化方式为_______,其中配体是_______,该配合物中有 键_______
键_______ 。
。

8.I.铝 三种化合物的沸点如下表所示:
三种化合物的沸点如下表所示:
铝的卤化物 |
|
|
|
沸点 | 1500 | 370 | 430 |
(1)解释三种卤化物沸点差异 原因_______。
原因_______。
(2)已知反应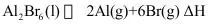 。
。
①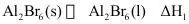
②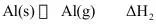
③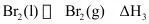
④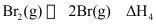
⑤
则 _______。
_______。
(3)由图可知,若该反应自发,则该反应的_______。
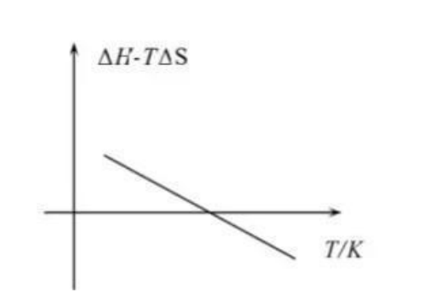
A.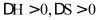 B.
B.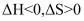 C.
C.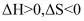 D.
D.
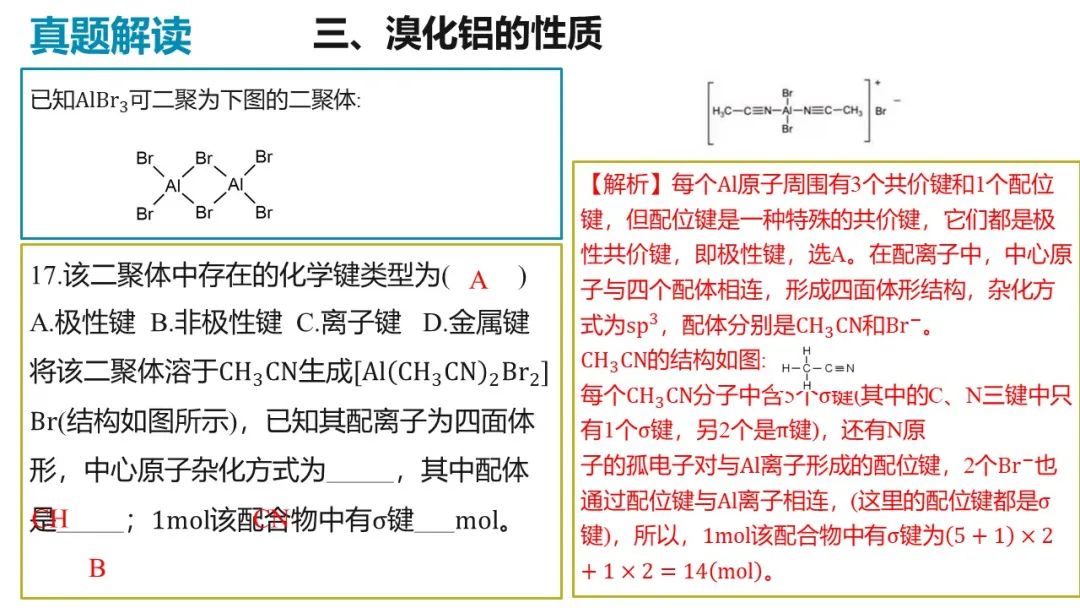
II.已如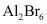 的晶胞如图所示(已知结构为平行六面体,各棱长不相等,
的晶胞如图所示(已知结构为平行六面体,各棱长不相等,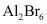 在棱心)
在棱心)
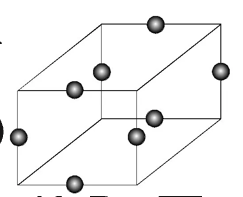
(4)该晶体中,每个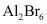 ,距离其最近的
,距离其最近的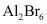 有_______个。
有_______个。
A.4B.5C.8D.12
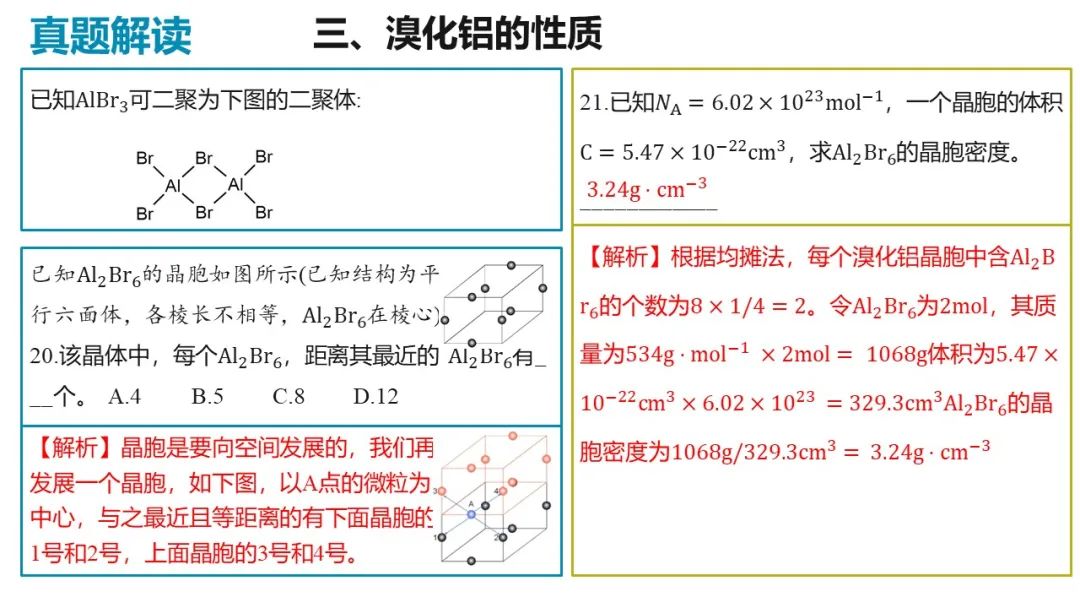
(5)已知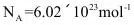 ,一个晶胞的体积
,一个晶胞的体积 。求
。求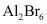 的晶胞密度_______。
的晶胞密度_______。
(6) 水解可得
水解可得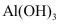 胶体,请解释用
胶体,请解释用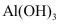 可净水的原因_______。
可净水的原因_______。
(7)用上述制得的胶体做电泳实验时,有某种胶体粒子向阴极移动,该粒子可能是_______。
A.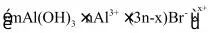 B.
B.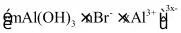
C.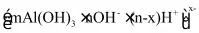 D.
D.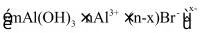
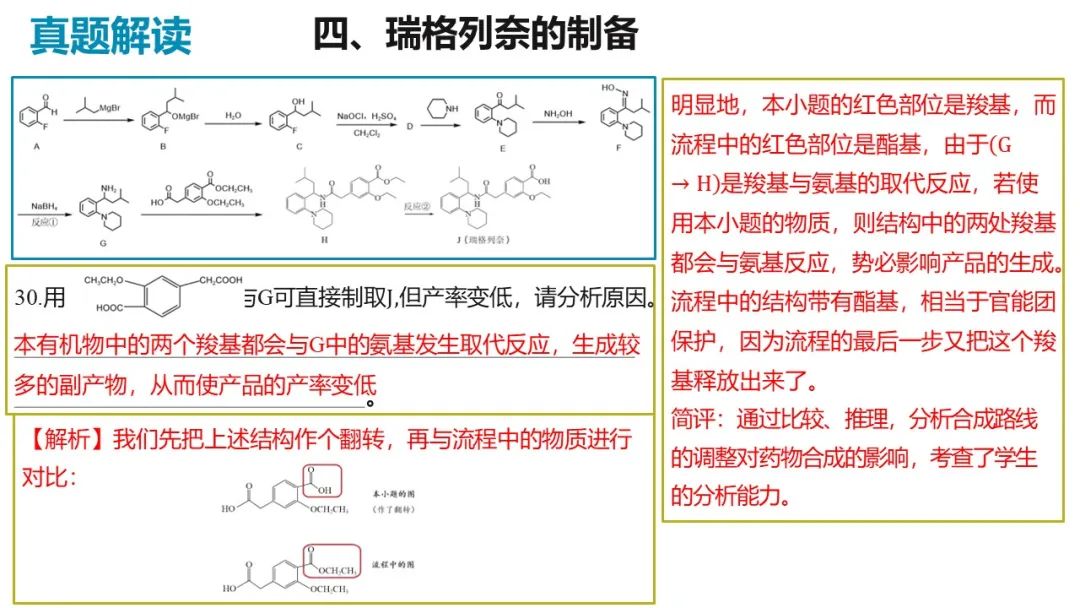
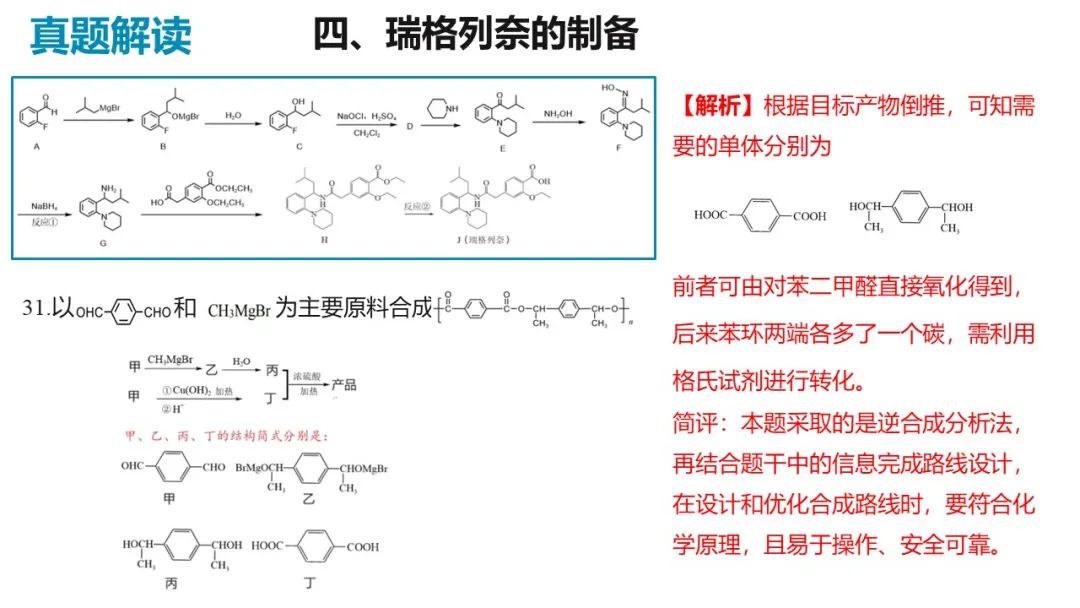
四、瑞格列奈的制备
9.瑞格列奈的制备。
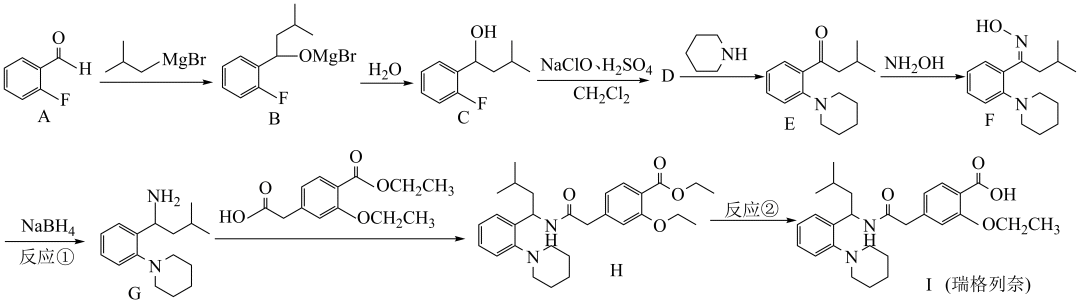
(1)瑞格列奈中的含氧官能团除了羧基、醚键,还存在_______。
(2)反应①的反应类型为_______。
A.还原反应B.消去反应C.取代反应D.氧化反应
(3)反应②的试剂和条件是_______。
(4)D的分子式是 ,画出D的结构简式_______。
,画出D的结构简式_______。
(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式_______。
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为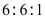 。
。
(6)G对映异构体分离后才能发生下一步反应
①G中有_______个手性碳
②已知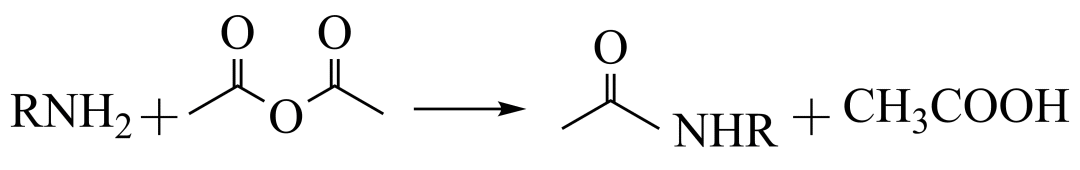 ,用
,用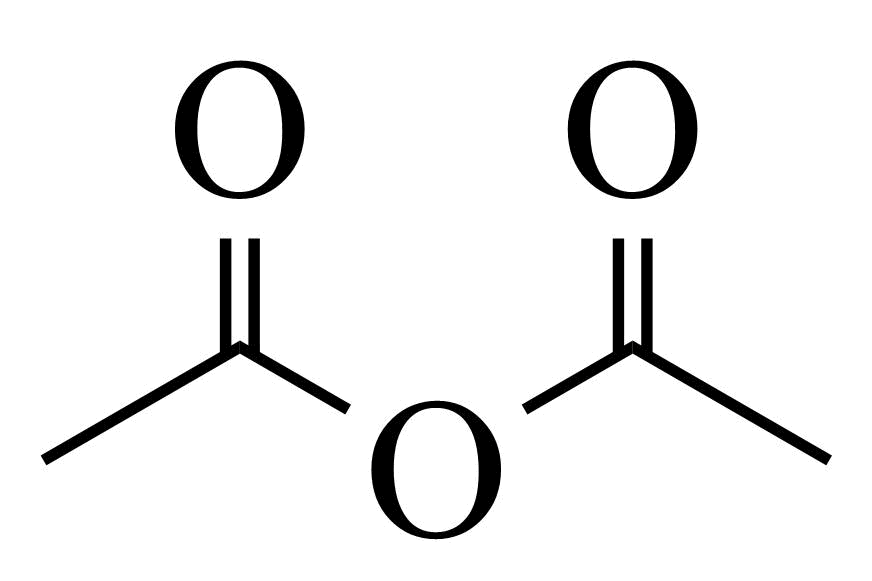 和谷氨酸可制备
和谷氨酸可制备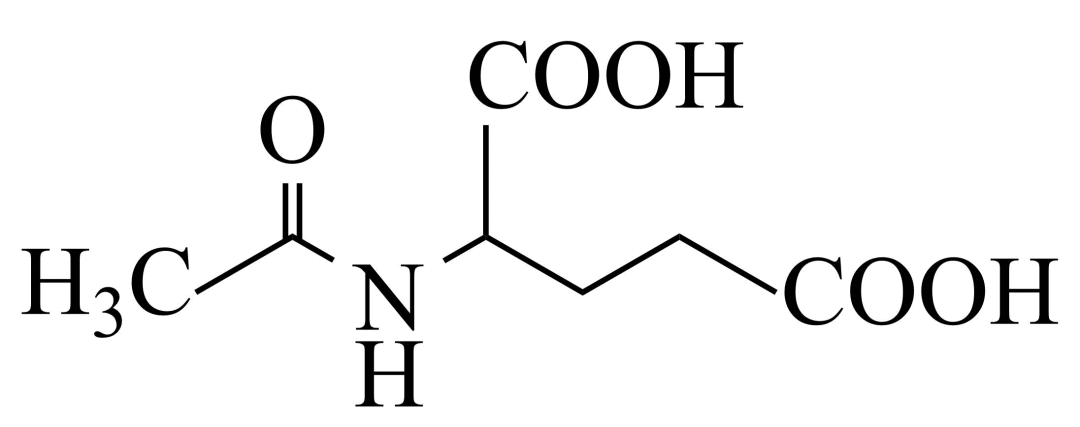 ,该物质可用于分离对映异构体。谷氨酸的结构简式为:_______。检验谷氨酸的试剂是_______。
,该物质可用于分离对映异构体。谷氨酸的结构简式为:_______。检验谷氨酸的试剂是_______。
A.硝酸B.茚三酮C. D.
D.
(7)用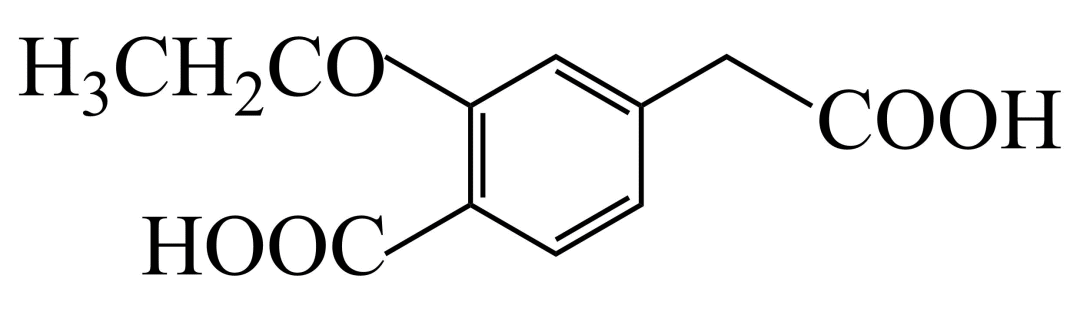 与G可直接制取H
与G可直接制取H 但产率变低,请分析原因_______。
但产率变低,请分析原因_______。
(8)以 和
和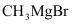 合成
合成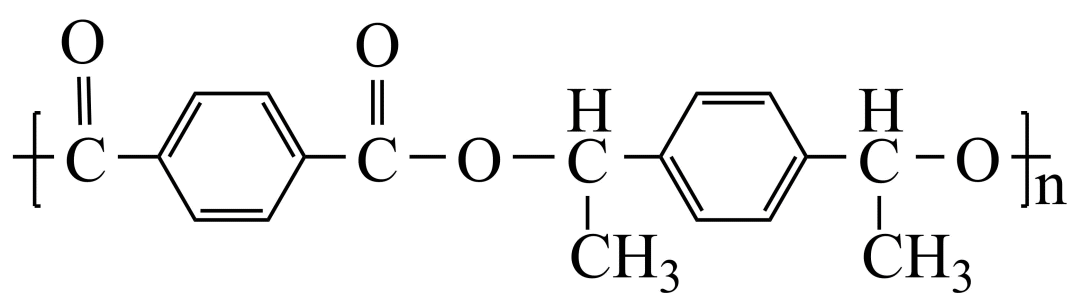 _______。
_______。
五、珊瑚的形成与保护
10.已知: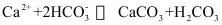
①
②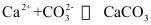
③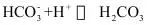
(1)以下能判断总反应达到平衡状态的是_______。
A.钙离子浓度保持不变B.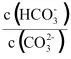 保持不变
保持不变
C.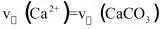 D.
D.
(2) 增大有利于珊瑚的形成,请解释原因_______。
增大有利于珊瑚的形成,请解释原因_______。
(3)已知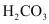 的
的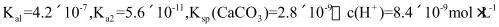 为_______。当
为_______。当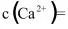 _______
_______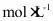 时,开始产生
时,开始产生 沉淀。
沉淀。
(4)根据如图,写出电极a的电极反应式_______。
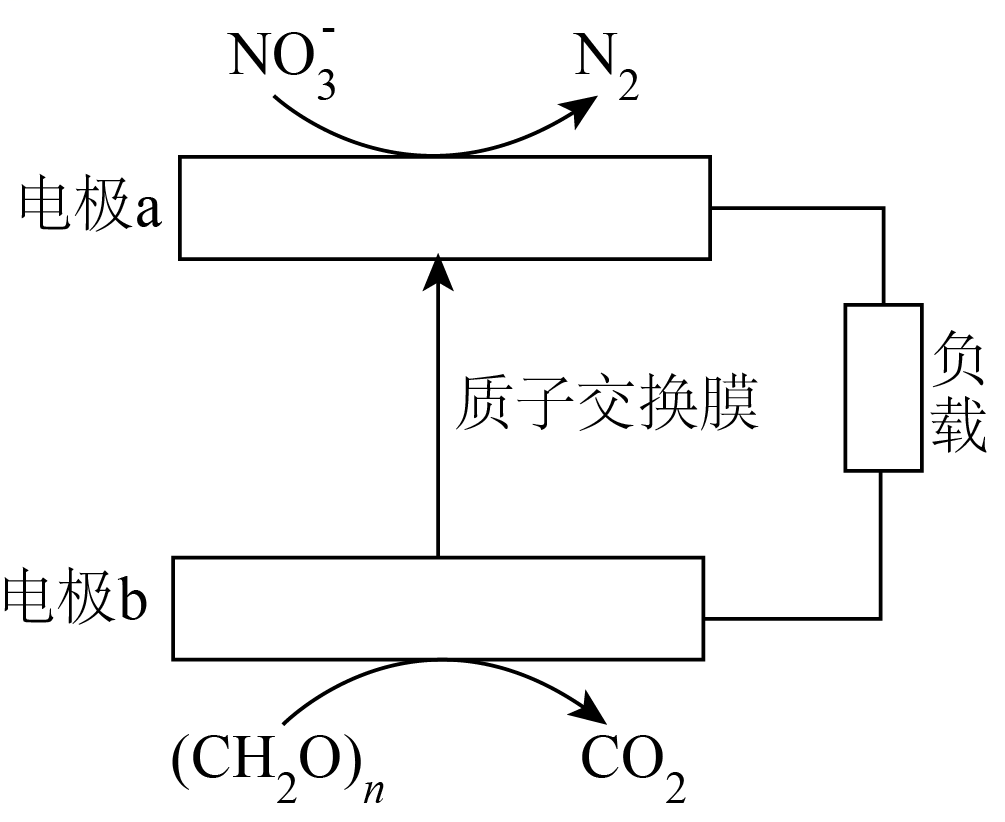
(5)关于上述电化学反应过程,描述正确的是_______。
A.该装置实现电能转化为化学能
B.电极b是负极
C.电子从电极a经过负载到电极b再经过水体回到电极a
D.每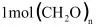 参与反应时,转移
参与反应时,转移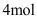 电子
电子
(6)解释在溶液中氧气的浓度变大后,为何有利于 的除去,但不利于硝酸根的除去。_______。
的除去,但不利于硝酸根的除去。_______。

















本文关键词:24上海高考化学解析
本文由小编发布,不代表一本线高考网立场,转载联系作者并注明出处:https://www.yibenxian.com/ziliao/56647.html